El cobre es un oligoelemento esencial necesario para el normal crecimiento y metabolismo de los organismos vivos. Sin embargo, puede ser tóxico si hay una sobreexposición a éste.
Los niveles de cobre disueltos aumentan a menudo por causas antropogénicas, como el lavado de minerales (relave) y la directa aplicación de alguicidas, molusquicidas o agentes antifouling (antiincrustantes)
La forma más toxica del cobre es el ion cúprico (Cu2+). Peces y crustáceos son 10 a 100 veces más sensibles a la toxicidad del cobre que los mamíferos. Para salmónidos, el límite superior recomendado e < 0.03 mg/l en agua dura (>100 mg/l CaCo3), mientras que en agua blanda es <0.0006 mg/l.
Al igual que muchos otros contaminantes transmitidos por el agua, y particularmente como otros metales pesados, el principal objetivo de la acción tóxica del cobre en peces son sus branquias. Altas concentraciones de cobre resultan en rápida mortalidad, en parte una consecuencia de la hipoxemia, probablemente debido a cambios histopatológicos como tumefacción celular y engrosamiento de laminillas, congestión, telangiectasia, desprendimiento epitelial, sinequias o incluso fusión de laminillas. Estos cambios conducen a una reducción total en el área de superficie branquial y flujo de agua laminar perjudicado, lo que tiene el efecto atenuante de reducir la exposición al contaminante. Desafortunadamente, esta misma respuesta perjudica la captación de oxígeno y la excreción de dióxido de carbono, que a su vez conduce a un aumento de la PCO2 y acidosis (lactato sanguíneo aumentado). Sin embargo, en lugar de la hipoxemia, la mortalidad resulta probablemente de una perturbación ionoreguladora que induce a hipertensión, llevando a colapso cardiovascular.
Junto con el intercambio gaseoso afectado, también se ha reportado que el cobre afecta el balance salino, balance acido-base, y excreción de amoniaco, presumiblemente debido a la inhibición de la Na+/K+/ATPasa, anhidrasa carbónica y excreción transcelular de amoniaco. Sin embargo, a la fecha hay poca evidencia que apoye estos efectos de la exposición al cobre. Adicionalmente, se sugiere que la exposición subletal a cobre de peces marinos y agua dulce induce un incremento en los niveles plasmáticos de cortisol, lo que causaría un incremento en el catabolismo proteico, explicando de este modo la hiperamonemia.
Además de afectar el balance salino en peces, el cobre puede también tener un impacto negativo en el rendimiento reproductivo a concentraciones mucho más bajas que las requeridas para inducir mortalidad o reducción de crecimiento. El mecanismo por el cual el cobre afecta la reproducción es desconocido pero podría ser un simple resultado de la reducción de la disponibilidad de recursos que surge cuando se debe dedicar energía a lidiar con los desafíos fisiológicos inducidos por el cobre en lugar de un efecto endocrino directo.
El cobre en bajas concentraciones afecta la eclosión. Puede inactivar la corionasa y causar disturbios osmóticos que pueden también afectar su actividad o los movimientos musculares necesarios para romper el cascarón. También ha sido asociado con baja pigmentación de los embriones, deformación de la médula espinal, malformaciones craneales, subdesarrollo mandibular, disminución del largo, aumento del tiempo de absorción del vitelo, edema y opacidad del saco vitelino.
El impacto de la exposición al cobre en el sistema inmune está asociado con una disminución en la función fagocítica de macrófagos y producción de anticuerpos.
Además de esto, puede afectar el metabolismo de la glucosa y estructura celular en peces. La exposición al cobre causa aumento en los niveles de glucosa sanguínea, lo que conduce a supresión del apetito, y por lo tanto disminución de la ingesta de alimento. Este proceso ocurre por los cambios hormonales que estimulan el metabolismo del glicógeno hepático en glucosa sanguínea (glucogenólisis). Todo ello influye en la alta demanda energética necesaria para la coordinación metabólica en el hígado y así mantener el proceso de desintoxicación para superar el estrés químico.
El sistema olfatorio puede ser también afectado. El cobre puede dañar el epitelio olfatorio y al mismo tiempo reduce las respuestas neurofisiológicas hacia el estímulo olfatorio.
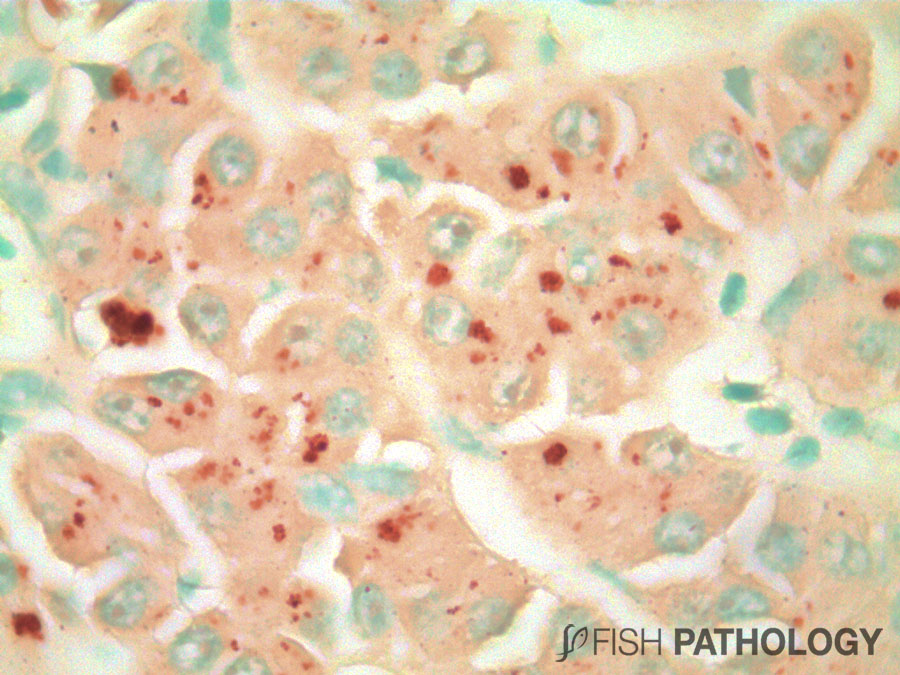
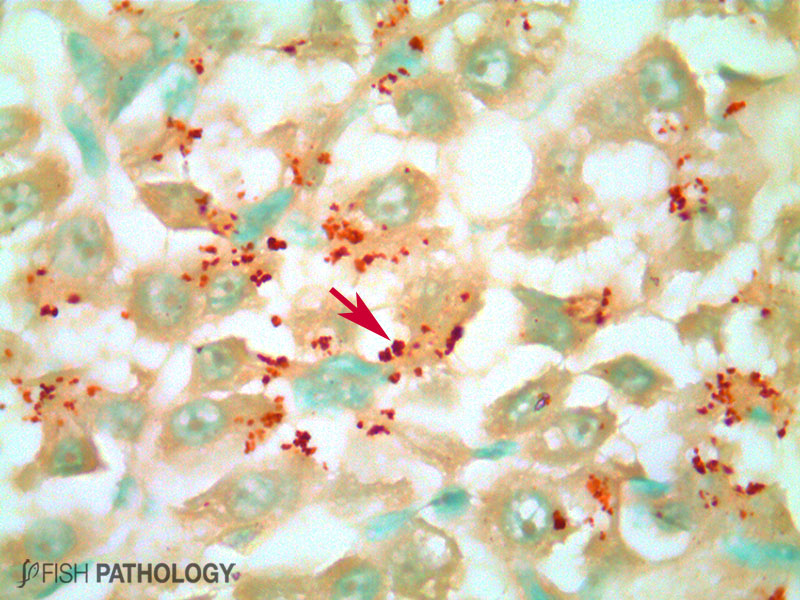
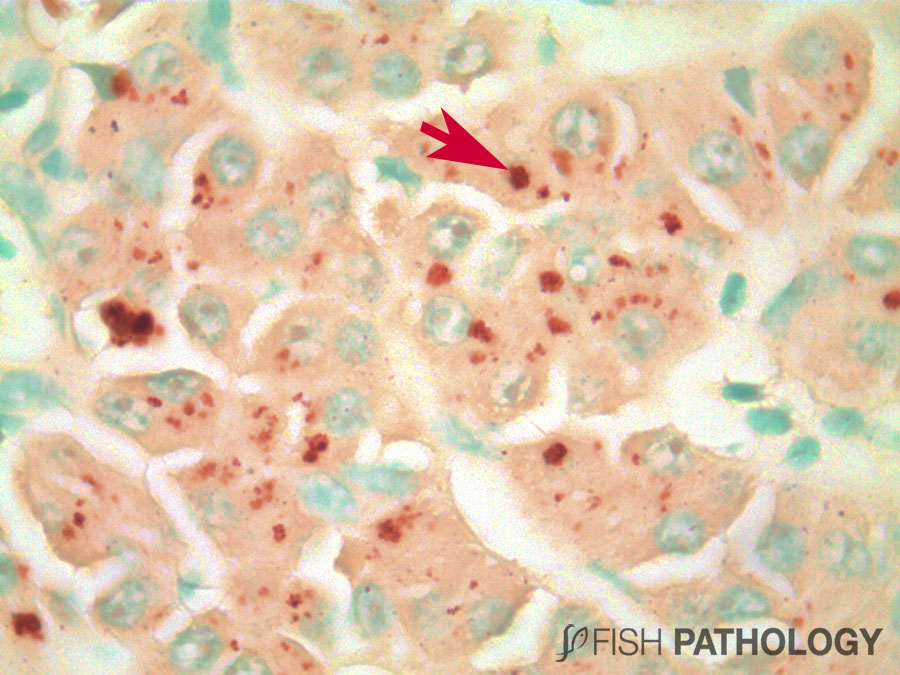
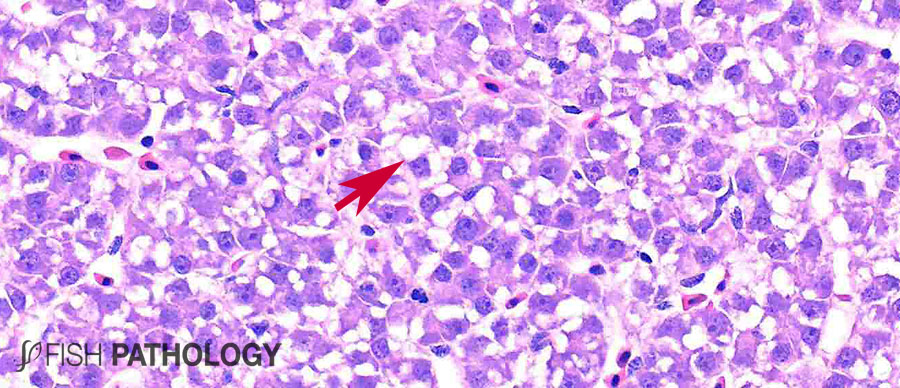
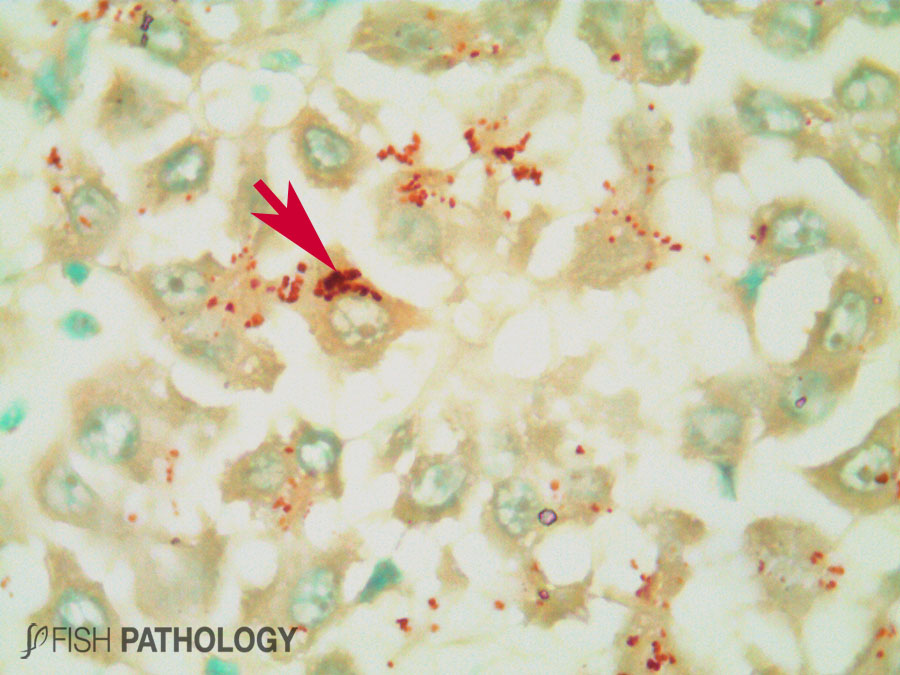
Aunque el hígado y el riñón son típicamente importantes en el almacenamiento y acumulación de metales en peces, el metabolismo del cobre es principalmente controlado por el hígado, jugando un importante rol en la homeostasis del cobre. El hígado es el órgano más reactivo ante la acumulación de cobre, porque es el sitio donde ocurren los procesos de detoxificación. Algunos cambios morfológicos en hígado incluyen vacuolización citoplasmática, dilatación de sinusoides, necrosis de hepatocitos, congestión de células sanguíneas y edema.
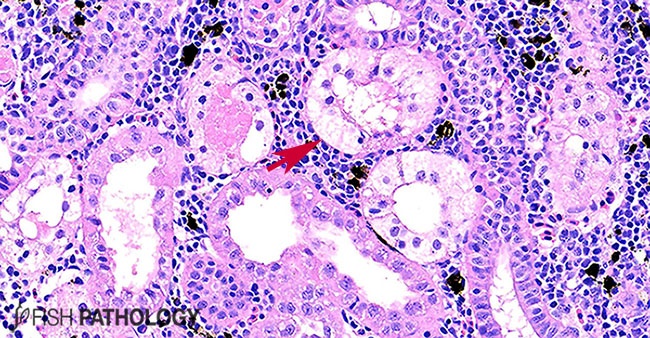
En el riñón, los peces pueden mostrar degeneración y necrosis del epitelio tubular, hemorragia tubular, contracción glomerular, daño de túbulos colectores y congestión intersticial.
REFERENCIAS
- Aghamirkarimi, S., Mashinchian, M. A., Sharifpour, I., Jamili, S., & GHAVAM, M. P. (2017). Sublethal Effects of Copper Nanoparticles on the Histology of Gill, Liver and Kidney of the Caspian Roach, Rutilus Rutilus Caspicus (Case Study).
- Al-Bairuty, G. A., Shaw, B. J., Handy, R. D., & Henry, T. B. (2013). Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology, 126, 104-115.
- Di Giulio, R. T., & Hinton, D. E. (Eds.). (2008). The toxicology of fishes. Crc Press.
- Ferguson, Hugh W. (2006). Systemic Pathology of Fish, London, UK, Scotian Press.
- Grosell, M. (2012). Homeostasis and toxicology of essential metals. Fish physiology, 31, 53-133.
- Jezierska, B., Ługowska, K., & Witeska, M. (2009). The effects of heavy metals on embryonic development of fish (a review). Fish physiology and biochemistry, 35(4), 625-640.
- Johnson, A., Carew, E., & Sloman, K. A. (2007). The effects of copper on the morphological and functional development of zebrafish embryos. Aquatic Toxicology, 84(4), 431-438.
- Jones, J., Wellband, K., Zielinski, B., & Heath, D. D. (2019). Transcriptional basis of copper-induced olfactory impairment in the sea lamprey, a primitive invasive fish. G3: Genes, Genomes, Genetics, 9(3), 933-941.
- Mahboob, S., Al-Ghanim, K. A., Al-Balawi, H. F., Al-Misned, F., & Ahmed, Z. (2020). Toxicological effects of heavy metals on histological alterations in various organs in Nile tilapia (Oreochromis niloticus) from freshwater reservoir. Journal of King Saud University-Science, 32(1), 970-973.
- Padrilah, S. N., Shukor, M. Y. A., Yasid, N. A., Ahmad, S. A., Sabullah, M. K., & Shamaan, N. A. (2018). Toxicity Effects of Fish Histopathology on Copper Accumulation. Pertanika Journal of Tropical Agricultural Science, 41(2).
- Sabullah, M. K., Ahmad, S. A., Shukor, M. Y., Gansau, A. J., Syed, M. A., Sulaiman, M. R., & Shamaan, N. A. (2015). Heavy metal biomarker: Fish behavior, cellular alteration, enzymatic reaction and proteomics approaches. International Food Research Journal, 22(2).
- Suchismita, D., & Abhik, G. (2013). Accumulation of copper in different tissues and changes in oxygen consumption rate in Indian flying barb, Esomus danricus (Hamilton-Buchanan) exposed to sub-lethal concentrations of copper. Jordan Journal of Biological Sciences (JJBS), 6(1), 21-24.
- Wood Chris, M., Farrell Anthony, P., & Brauner Colin, J. (2011). Homeostasis and toxicology of essential metals edited. Fish Physiology. London: Academic Press, 31(Part A), 1-497.