La anemia infecciosa del salmón (ISA) es una enfermedad causada por el virus de la anemia infecciosa del salmón (ISAV), perteneciente al género Isavirus, familia Orthomyxoviridae que afecta principalmente al salmón del Atlántico (Salmo salar) de piscicultura marina. Registrado por primera vez en 1984 en Noruega, todavía causa brotes epidémicos recurrentes en Chile. La enfermedad está presente en la mayoría de los países que cultivan salmón del Atlántico: Noruega, Escocia, Irlanda, Islas Feroe, Canadá, Estados Unidos y Chile.
El virus se encuentra adaptado a los peces salmónidos de agua fría y tiene un crecimiento óptimo a 15 °C. El salmón del Atlántico es la única especie conocida que desarrolla enfermedades clínicas, pero ISAV puede replicarse en trucha de mar (Salmo trutta) y trucha arcoíris (Oncorhynchus mykiss).
Un brote de ISAV se desarrolla lentamente, pero la mayoría de los peces de una población infectada pueden sucumbir durante el ciclo de producción; la mortalidad durante un brote puede variar significativamente. La mortalidad diaria oscila entre el 0,05% y el 0,1%, aunque la mortalidad acumulada puede alcanzar el 90% durante períodos prolongados. Los brotes en el salmón del Atlántico ocurren principalmente en agua de mar, pero se han reportado enfermedades clínicas y mortalidad en agua dulce.
Es una enfermedad contagiosa que puede mantener la inactividad fuera del huésped durante largos períodos y puede propagarse por agua. El virus puede propagarse en el agua a través de mucus, piel, heces, orina, sangre y por medio de los desechos de peces muertos. La diseminación del virus de peces infectados puede ocurrir a través de secreciones o excreciones naturales. La enfermedad puede propagarse a otras granjas, utilizando rutas como la transmisión pasiva en el agua o a través de equipos contaminados, tráfico de barcos o el movimiento de peces. La proximidad a centros con brotes de ISAV es un riesgo de importancia primordial, y el riesgo aumenta cuanto más cerca está una granja susceptible de una granja infectada. El virus se une a las membranas de los glóbulos rojos, por lo que controlar la propagación de la infección limitando el contacto o desinfectando el agua de sangre o el efluente de las plantas de procesamiento de pescado es de vital importancia.
Las branquias y la piel son los portales más probables de entrada a los peces, aunque no se puede excluir la infección a través del intestino. Los individuos pueden albergar el virus durante varias semanas antes del desarrollo de la enfermedad.
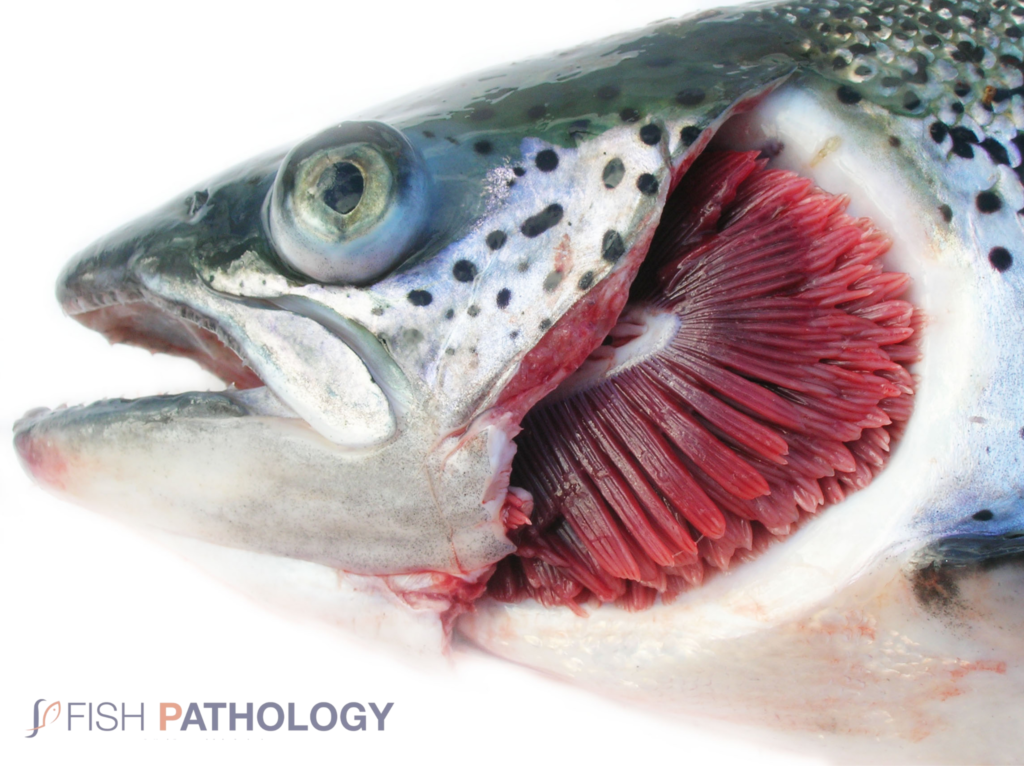
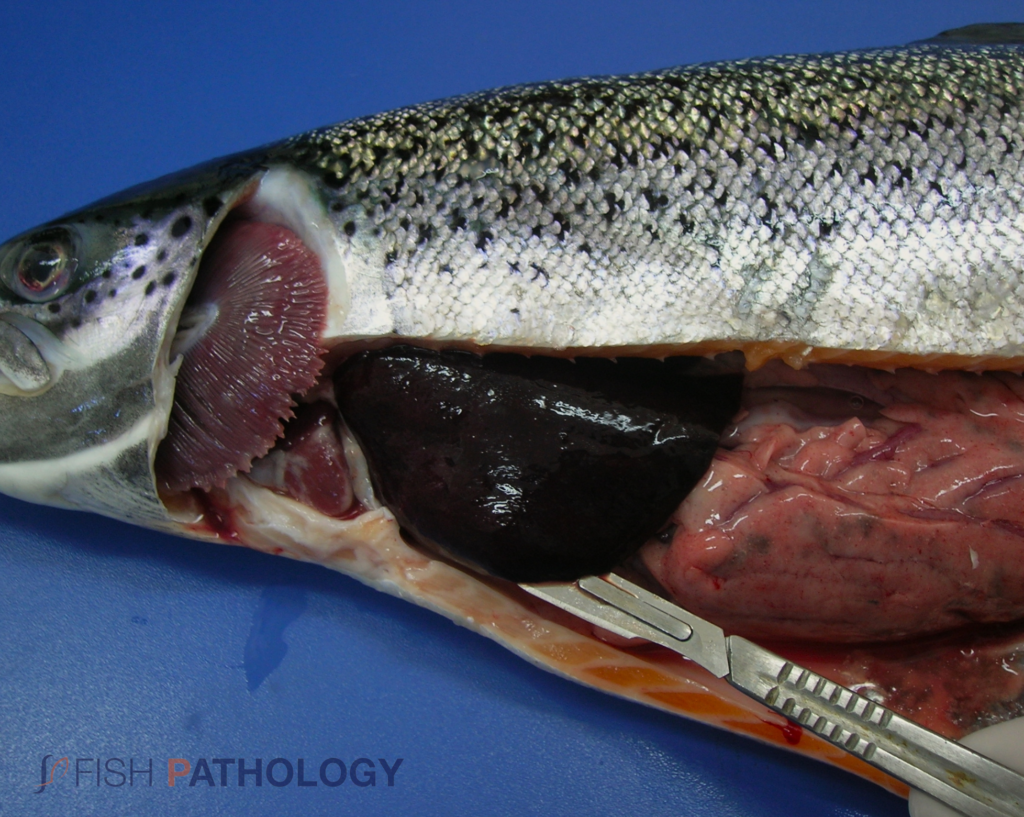
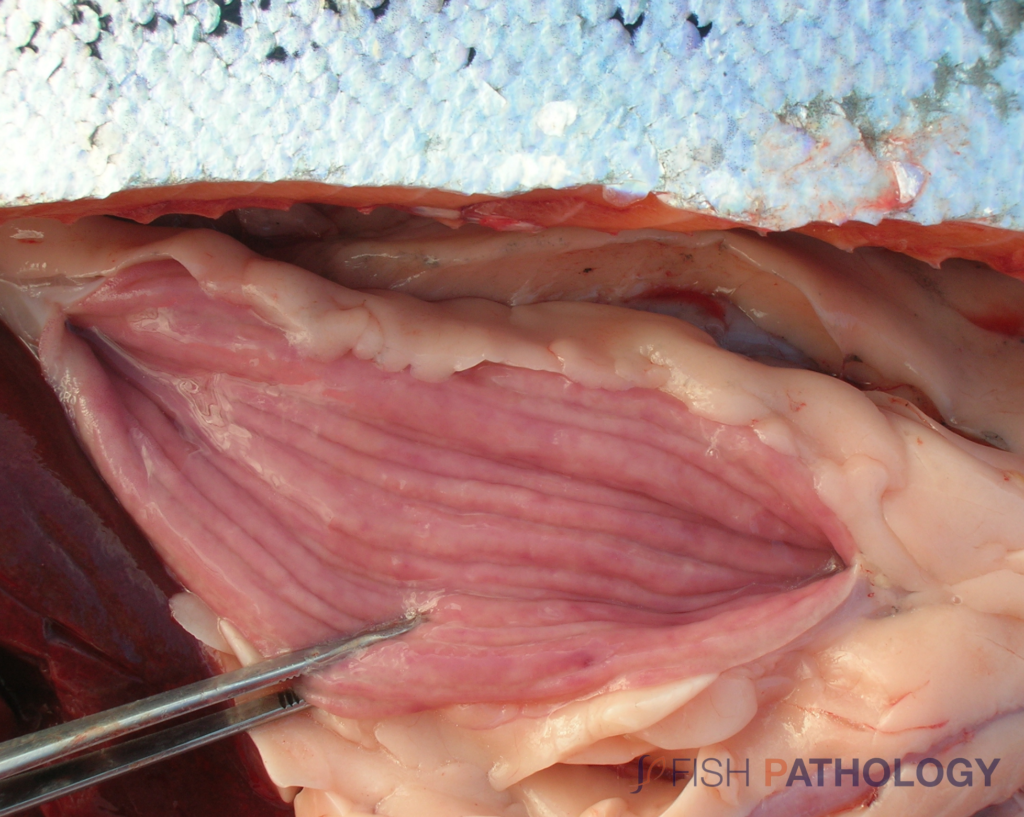
La enfermedad se presenta como una condición sistémica caracterizada principalmente por anemia severa y hemorragia, con necrosis en varios órganos, pero notablemente en el hígado. Los peces se demuestran letárgicos, pueden mostrar un comportamiento anormal de nado y pueden hundirse en el fondo de la jaula o mantenerse cerca de la pared del corral de la red. Los signos externos incluyen branquias pálidas, abdomen distendido, petequia en la cámara ocular, exoftalmía, edema de bolsillo de escamas y hemorragias cutáneas.
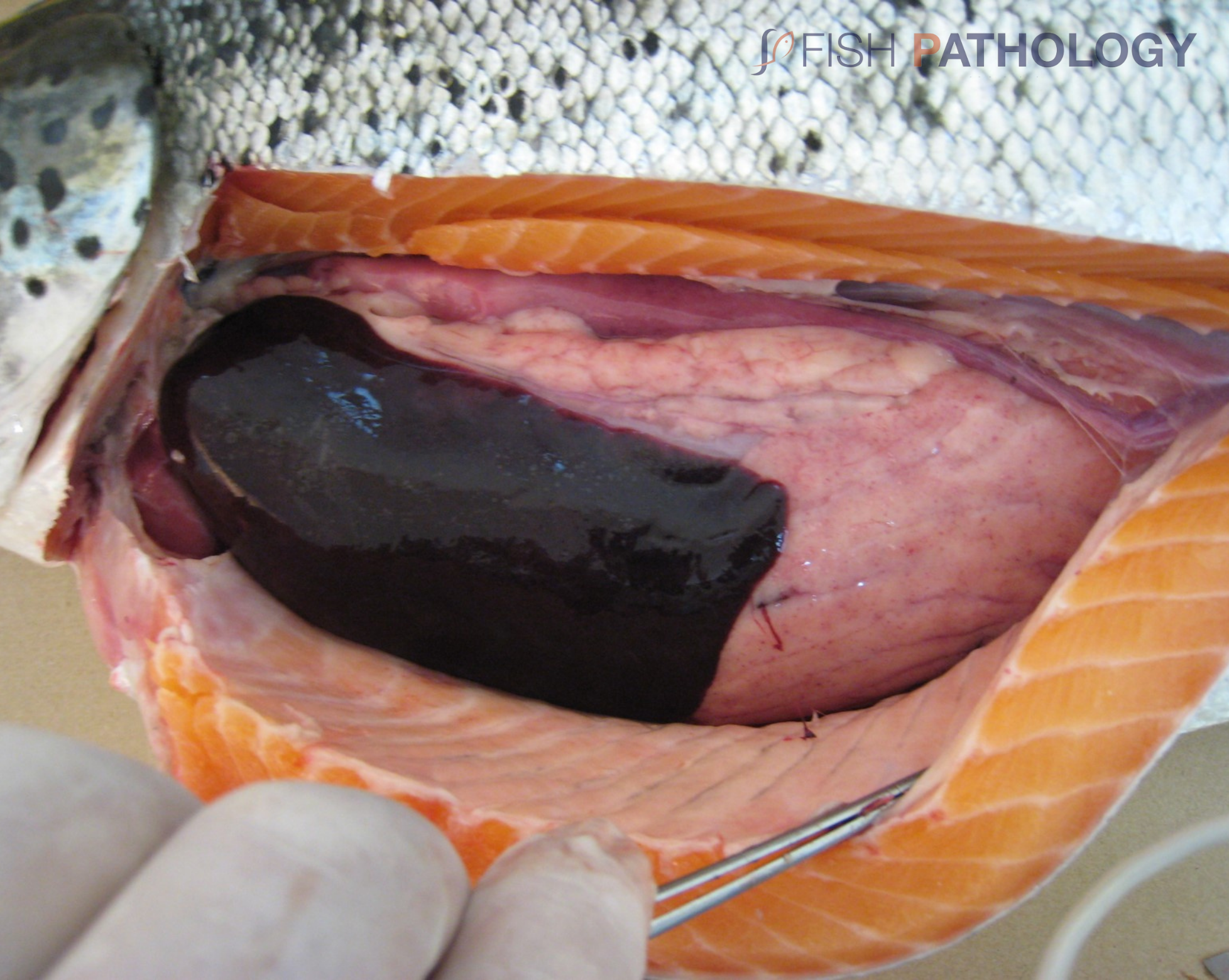
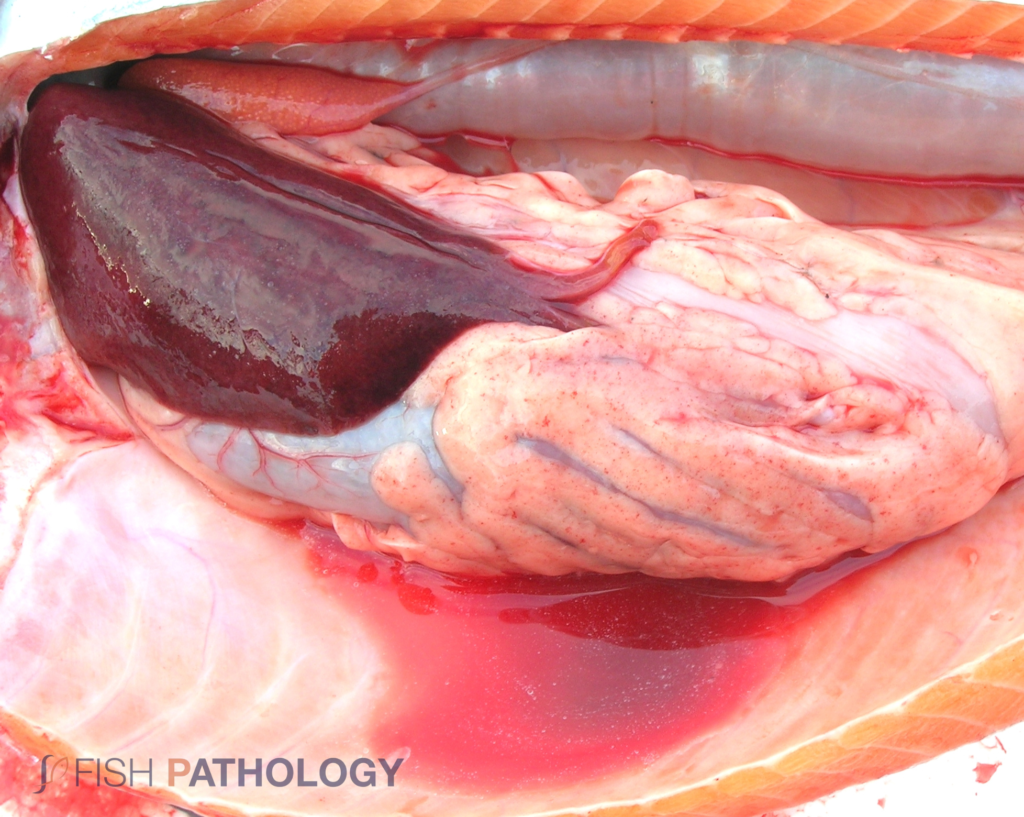
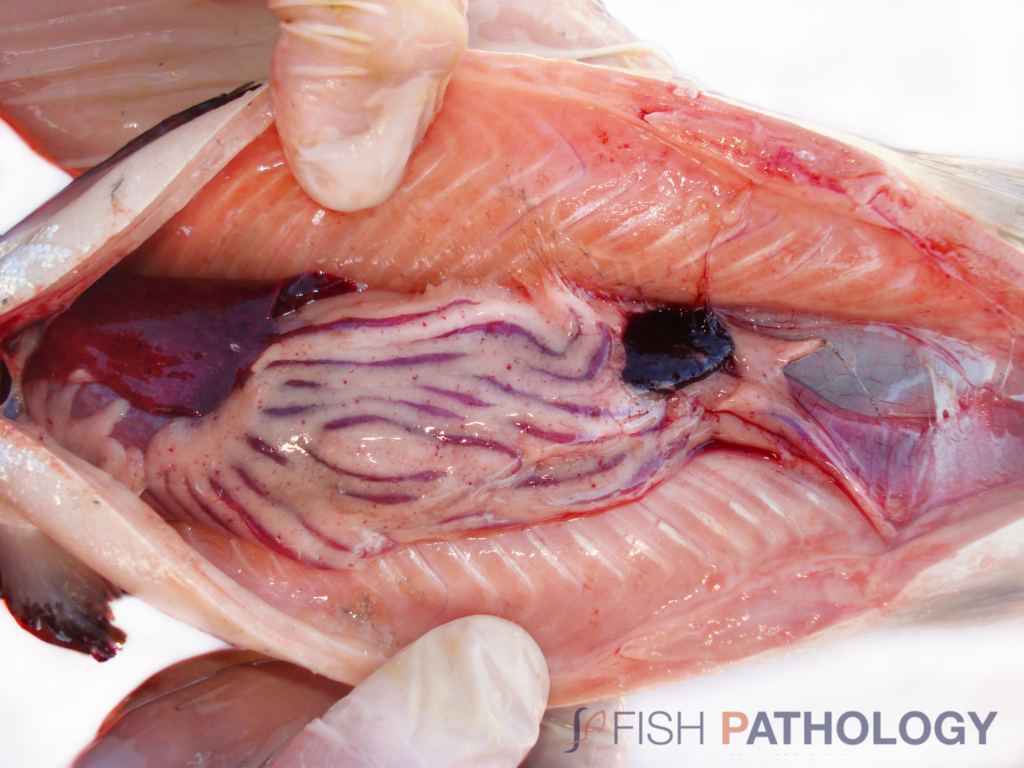
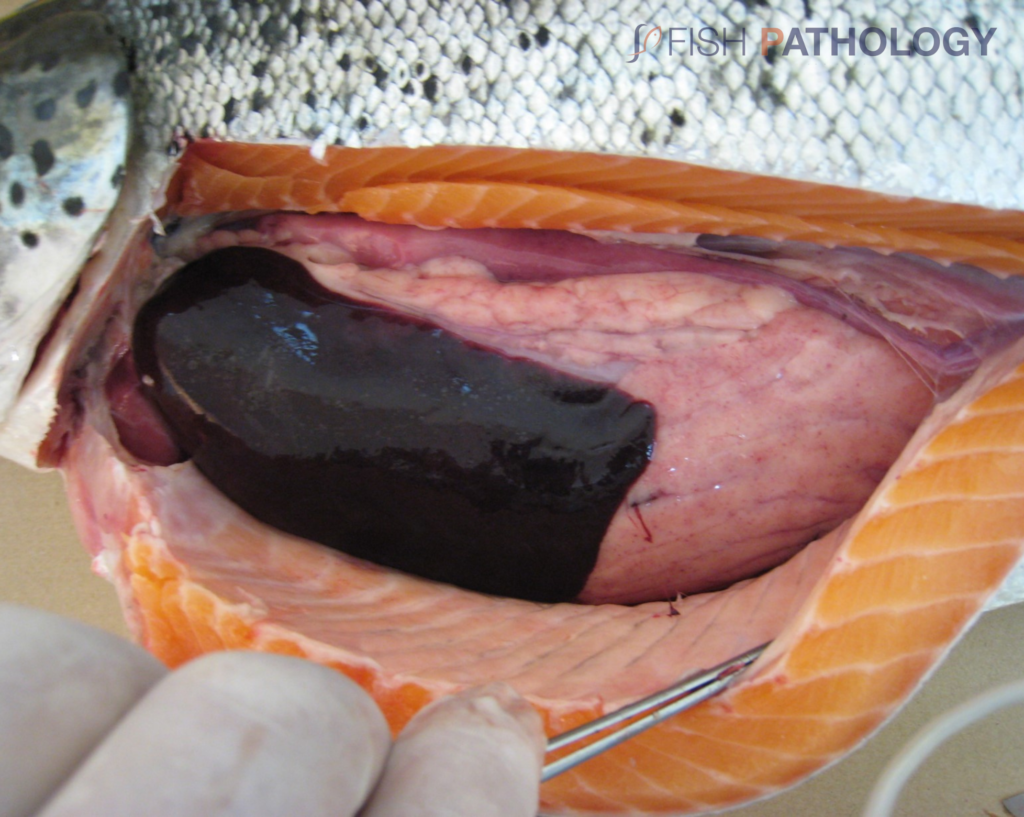
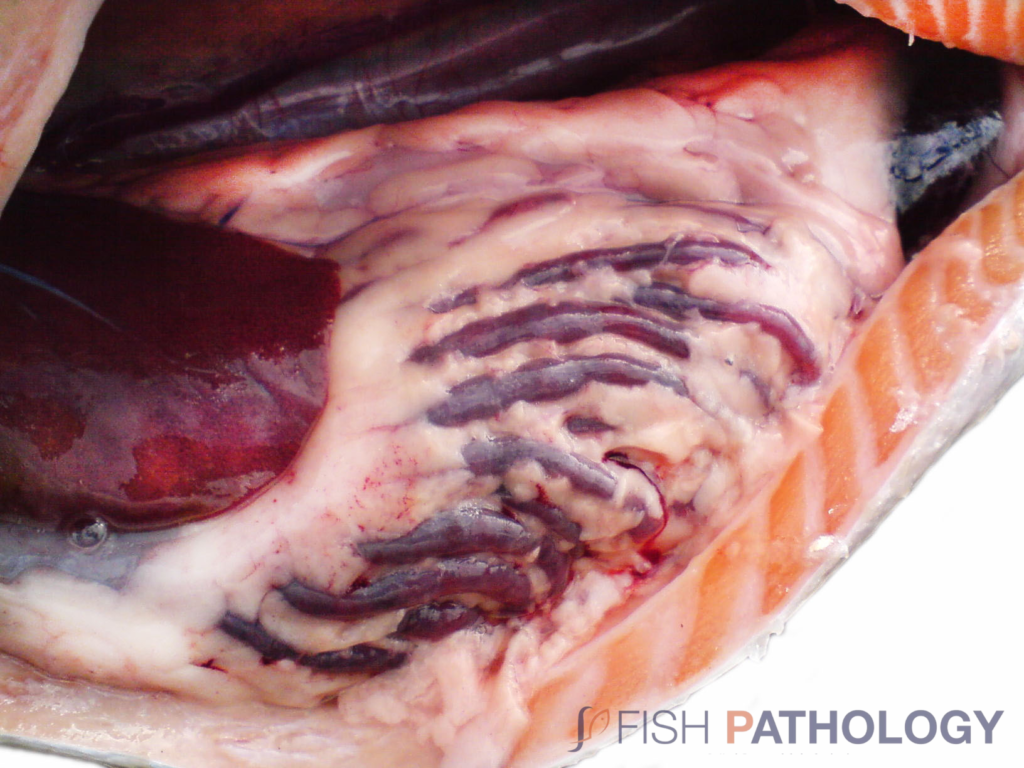
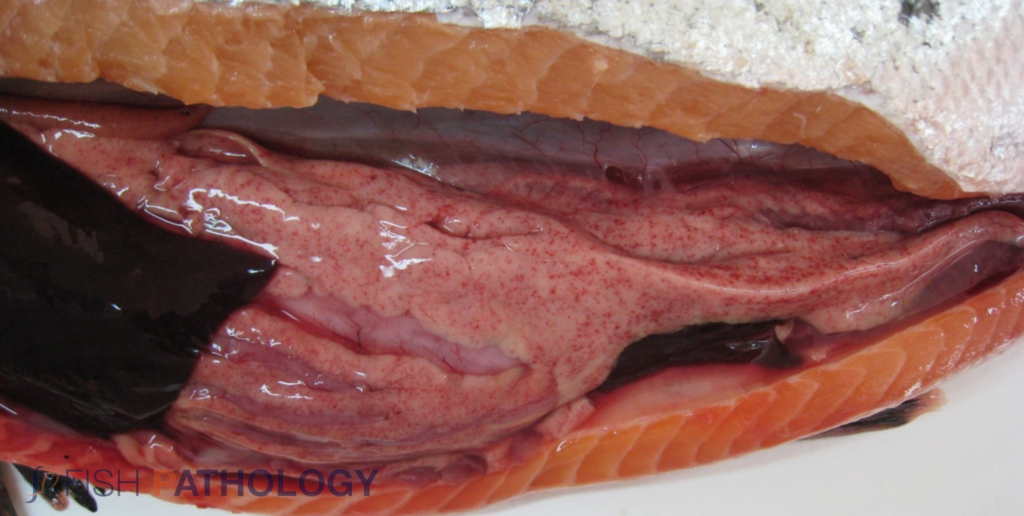
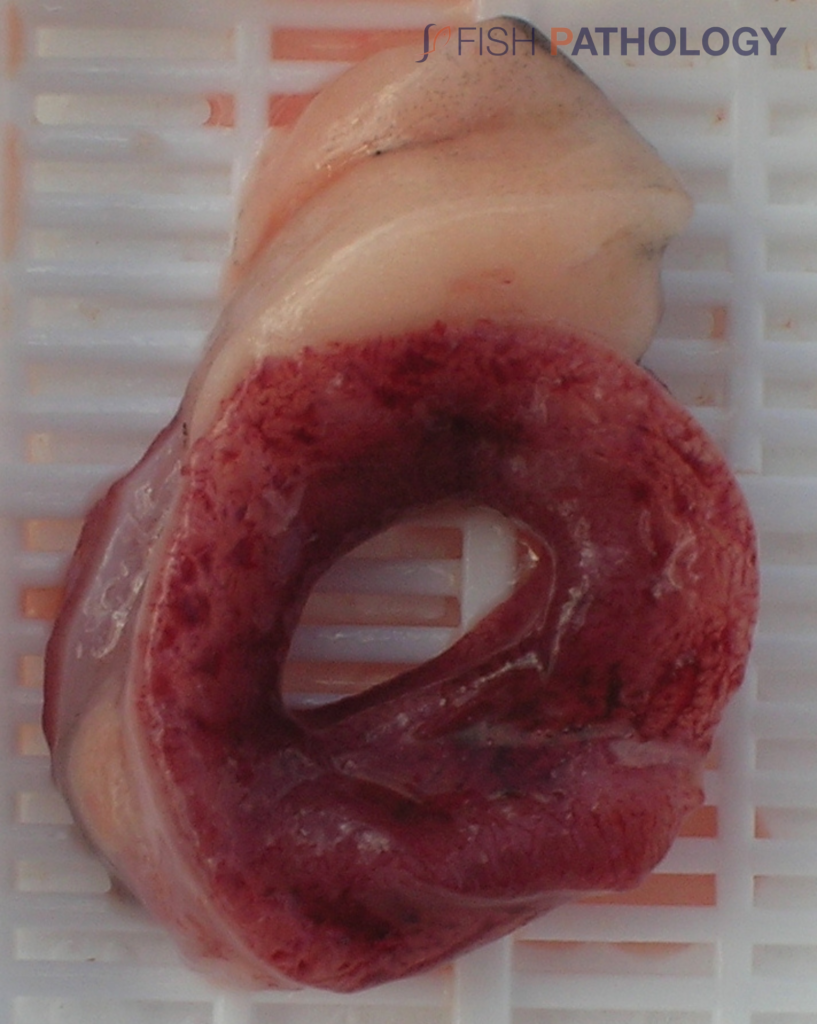
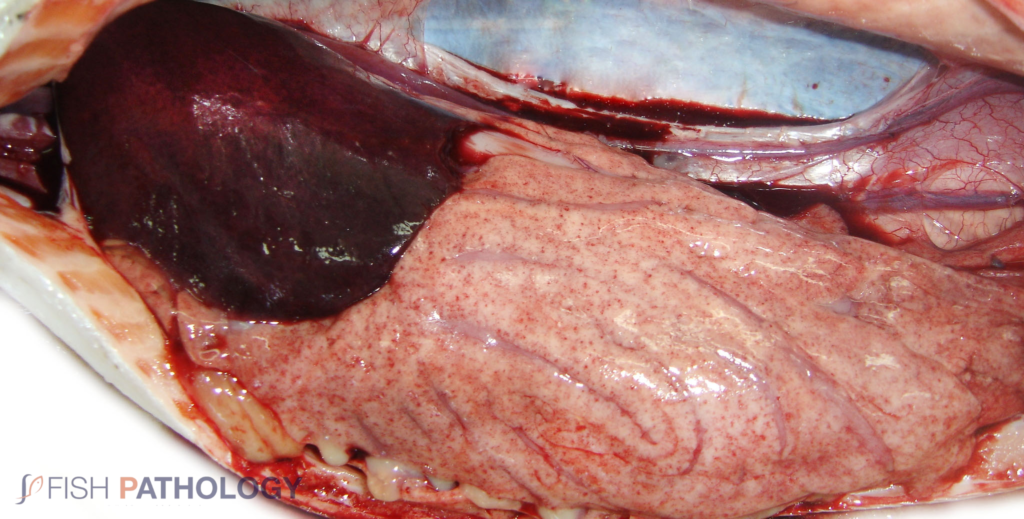
Los hallazgos post mortem macroscópicos son principalmente anemia y trastornos circulatorios en varios órganos, como hígado, riñón, branquias e intestino. En general, los peces se observan sin alimento en el tracto digestivo.
Los cambios comúnmente observados en un brote de ISA incluyen un hígado congestionado irregular, bazo y riñón de color rojo oscuro hinchados, congestión del intestino, hemorragias petequiales del músculo esquelético, grasa peripilórica y peritoneo, y líquido teñido de sangre o amarillo en las cavidades peritoneal y pericárdica.






Referencias
AAMELFOT M., DALE O.B., WELI S., KOPPANG E.O. & FALK K. (2012). Expression of 4-O-acetylated sialic acids on Atlantic salmon endothelial cells correlates with cell tropism of Infectious salmon anemia virus. J. Virol., 86, 10571–10578.
ALDRIN M., LYNGSTAD T.M., KRISTOFFERSEN A.B., STORVIK B., BORGAN O. & JANSEN P.A. (2011). Modelling the spread of infectious salmon anaemia among salmon farms based on seaway distances between farms and genetic relationships between infectious salmon anaemia virus isolates. J.R. Soc. Interface, 8, 1346–1356.
DANNEVIG B H., MJAALAND S. & RIMSTAD E. (2008). Infectious Salmon Anemia Virus. Encyclopedia of Virology (Third Edition), 89-95.
KIBENGE F.S.B., GODOY M.G., WANG Y., KIBENGE M.J.T., GHERARDELLI V., MANSILLA S., LISPERGER A., JARPA M., LARROQUETE G., AVENDAÑO F., LARA M. & GALLARDO A. (2009). Infectious salmon anaemia virus (ISAV) isolated from the ISA disease outbreaks in Chile diverged from ISAV isolates from Norway around 1996 and was disseminated around 2005, based on surface glycoprotein gene sequences. Virol. J., 6, 88.
LEONG J C. (2008). Fish Viruses. Encyclopedia of Virology (Third Edition), 227-234.
NYLUND A., PLARRE H., KARLSEN M., FRIDELL F., OTTEM K.F., BRATLAND A., & SAETHER P.A. (2007). Transmission of infectious salmon anaemia virus (ISAV) in farmed populations of Atlantic salmon (Salmo salar). Arch. Virol., 152, 151–179.
OFFICE INTERNATIONAL DES EPIZOOTIES (OIE) (2019). Manual of Diagnosis Tests for Aquatic Animals. Infection with HPR-deleted or HPR0 Infectious Salmon Anemia, 1-16.
RIMSTAD E., DALE O.B., DANNEVIG B.H. & FALK K. (2011). Infectious Salmon Anaemia. In: Fish Diseases and Disorders, Volume 3: Viral, Bacterial and Fungal Infections, Woo P.T.K. & Bruno D., eds. CAB International, Oxfordshire, UK, 143–165.
THORUD K.E. & DJUPVIK H.O. (1988). Infectious salmon anaemia in Atlantic salmon (Salmo salar L). Bull. Eur. Assoc. Fish Pathol., 8, 109–111.
VIKE S., NYLUND A. & NYLUND A. (2008). ISA virus in Chile: evidence of vertical transmission. Arch. Virol., 154, 1-8.