Las interacciones negativas entre medusas y peces parece ser un problema creciente en la acuicultura. Esto se debe en gran medida al aumento en el número de medusas a causa del calentamiento global, disminución del número de predadores e intensificación de las operaciones de acuicultura en muchas áreas costeras alrededor del mundo. La mayoría de los problemas reportados han ocurrido en cultivos marinos de salmónidos en el noroeste de Europa. Sin embargo, otras operaciones acuícolas de Asia, Norte américa y Australia también han sido afectadas.
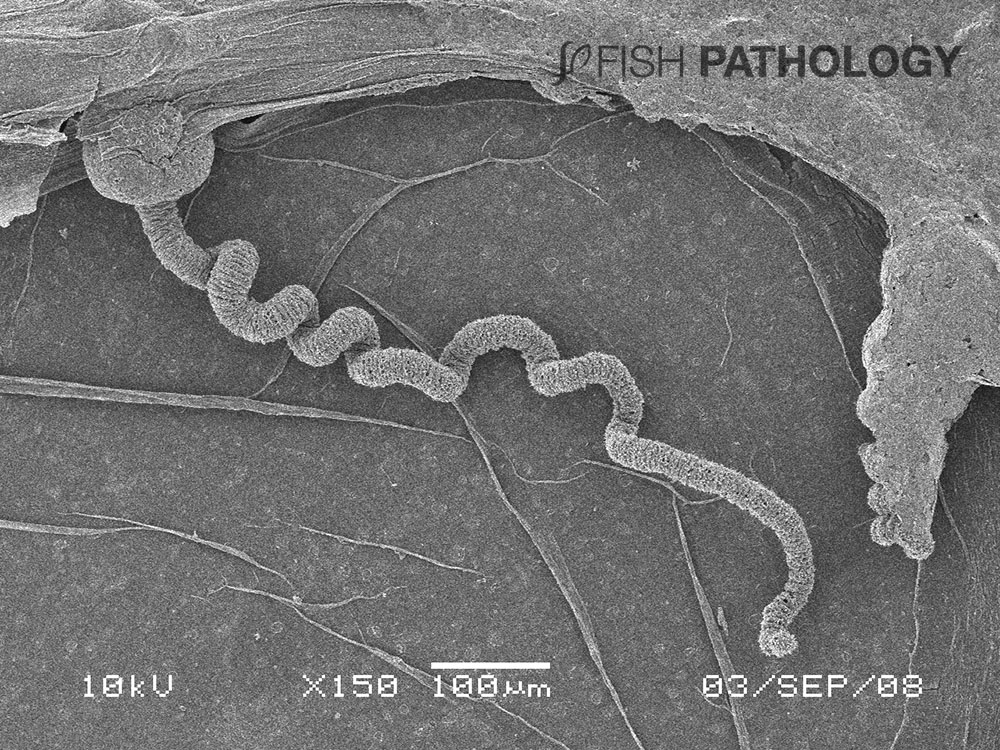
El daño inicial en las branquias causado por los cnidarios se debe en gran medida a las picaduras. Las medusas cnidarias se caracterizan por tener millones de células microscópicas urticantes, principalmente en sus tentáculos. Dentro de la célula se encuentra una cápsula urticante especializada llamada nematocisto (que en su mayoría mide 10-20 µm de longitud) que contiene un tubo hueco espiral como arpón a menudo armado de espículas. La liberación de los nematocistos puede ser activada por estimulación mecánica o química.
El nematocisto puede inyectar toxinas a la presa para inmovilizarla. Cuando se realiza la descarga del nematocisto se produce un daño mecánico causado por la penetración del tubo en el tejido, similar a un arpón. A esto le sigue un daño tóxico debido a la actividad de enzimas, neurotoxinas, miotoxinas y compuestos hemolíticos inyectados. Si el pez no muere inmediatamente por efecto de las toxinas, puede morir horas más tarde por falla respiratoria o infecciones bacterianas secundarias en branquias o generalizadas, causadas por bacterias oportunistas como Tenacibaculum y Vibrio. Se ha demostrado que algunas medusas actúan como vectores para este tipo de bacterias.
Las medusas involucradas son principalmente cnidarios, es decir, aquellas con células urticantes – nematocistos. Varias especies de medusas han sido previamente relacionadas con eventos de mortalidad en cultivos marinos de peces incluyendo hidromedusas, sifonóforos, escifozoos y ctenóforos.
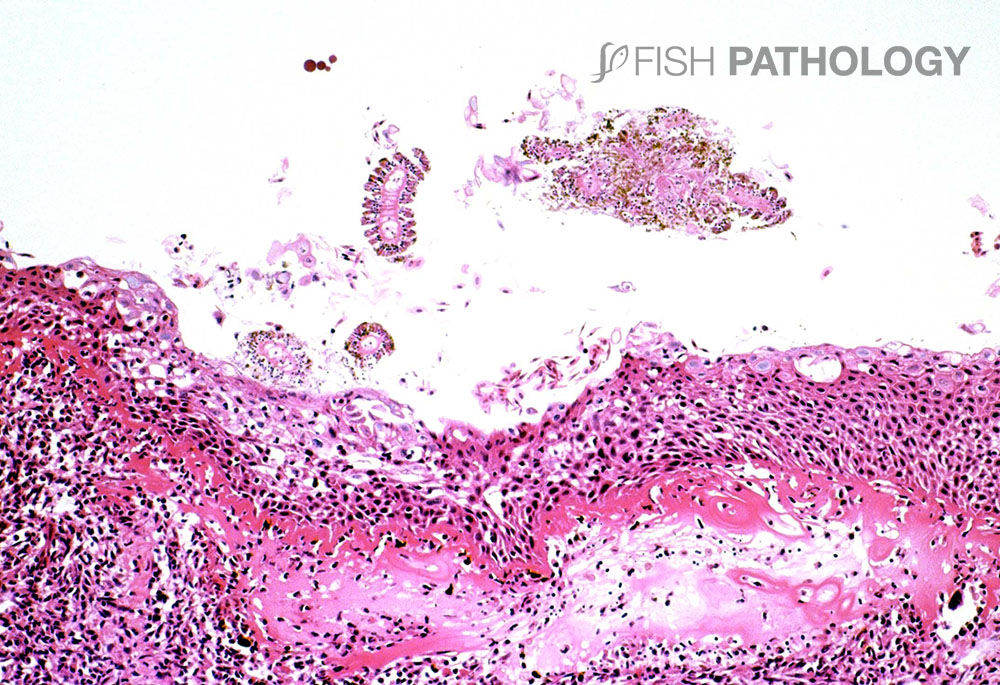
El daño hacia los peces puede ser directo, a través de la picadura de la piel y/o branquias, o puede ser indirecto a través de la desoxigenación del agua circundante. Si la especie de medusa involucrada es pequeña puede penetrar a través de las redes e incluso ser “inhalada” por los peces, dañando así las branquias. Los nematocistos sueltos que penetran a través de las mallas pueden llevar a problemas similares. Los nematocistos conservan su capacidad urticante hasta mucho después de que la medusa haya muerto.
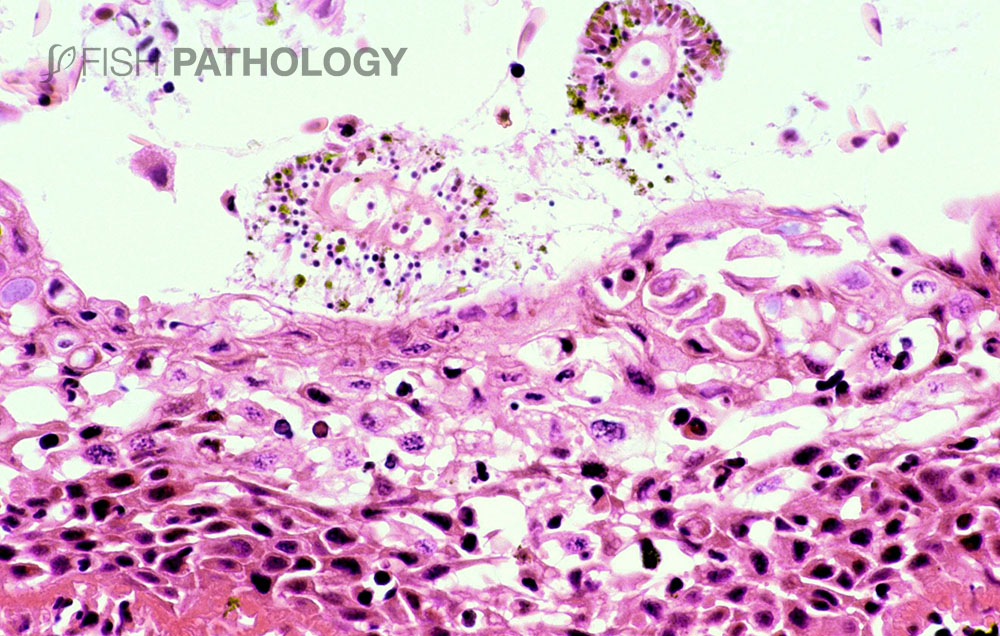
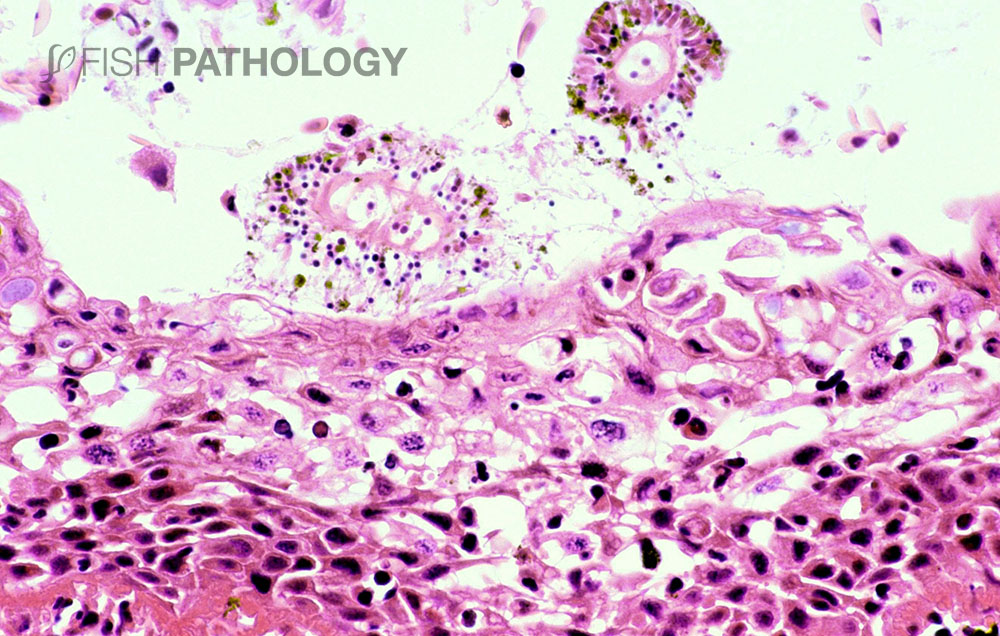
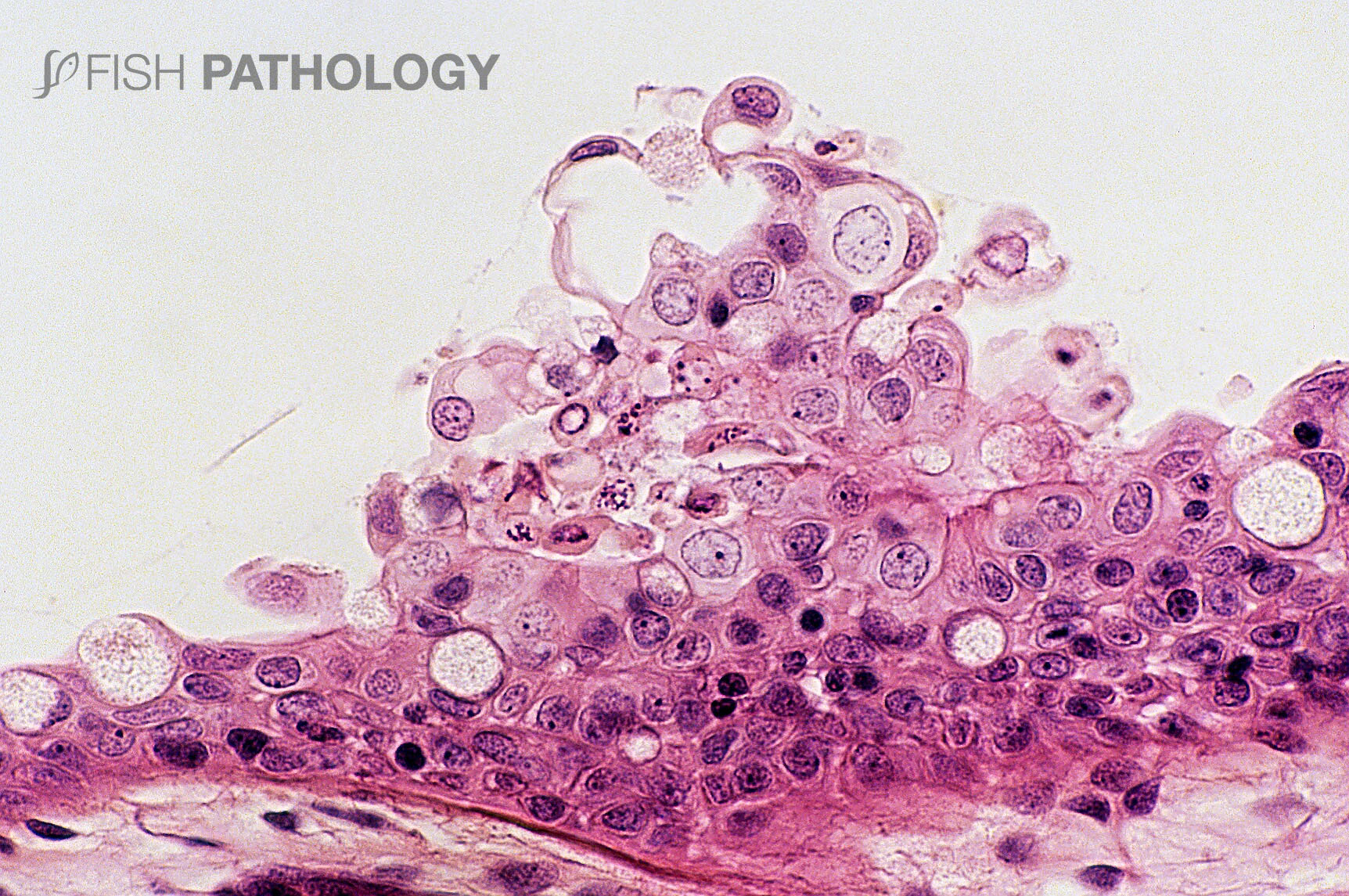
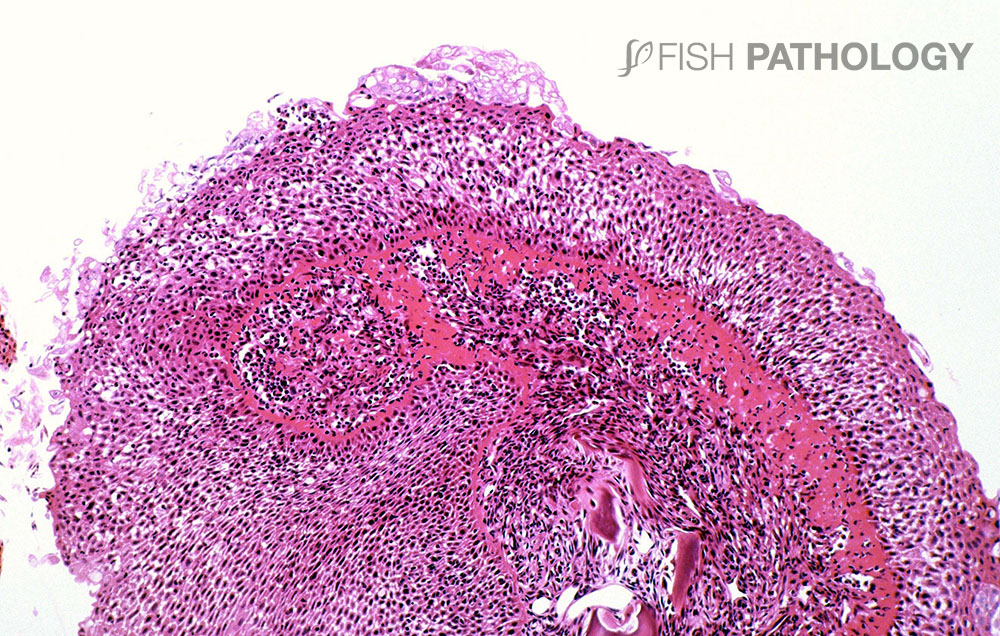
Los principales órganos afectados son branquias y piel. Los cambios en el epitelio respiratorio involucran degeneración y necrosis de epitelio lamelar, exfoliación de células epiteliales, fusión lamelar, congestión e infiltración de células inflamatorias, lo que lleva a un engrosamiento general de la lámina. En el epitelio del arco branquial las lesiones superficiales se caracterizan por degeneración balonizante (ballooning degeneration) multifocal aguda por espongiosis, degeneración hidrópica y por necrosis.
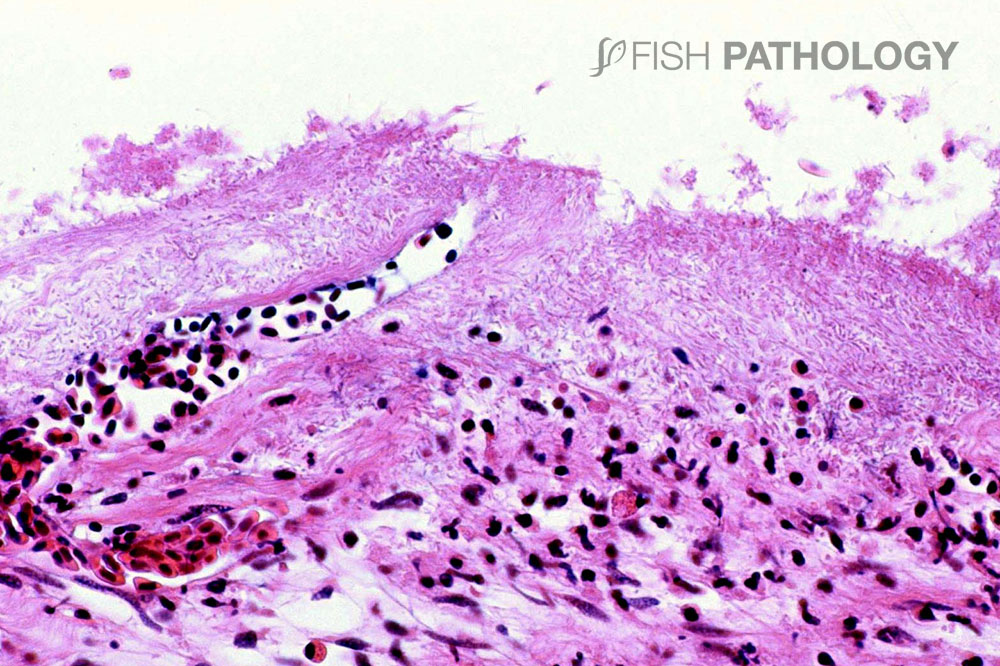
La respuesta inflamatoria es variable, pero es compuesta principalmente por neutrófilos. La presencia de una marcada eosinofilia en la membrana basal y capa subepitelial sugiere la desnaturalización del colágeno (necrobiosis). En algunos casos las espinas branquiales están severamente necróticas, con desprendimiento de epitelio e inflamación aguda severa.
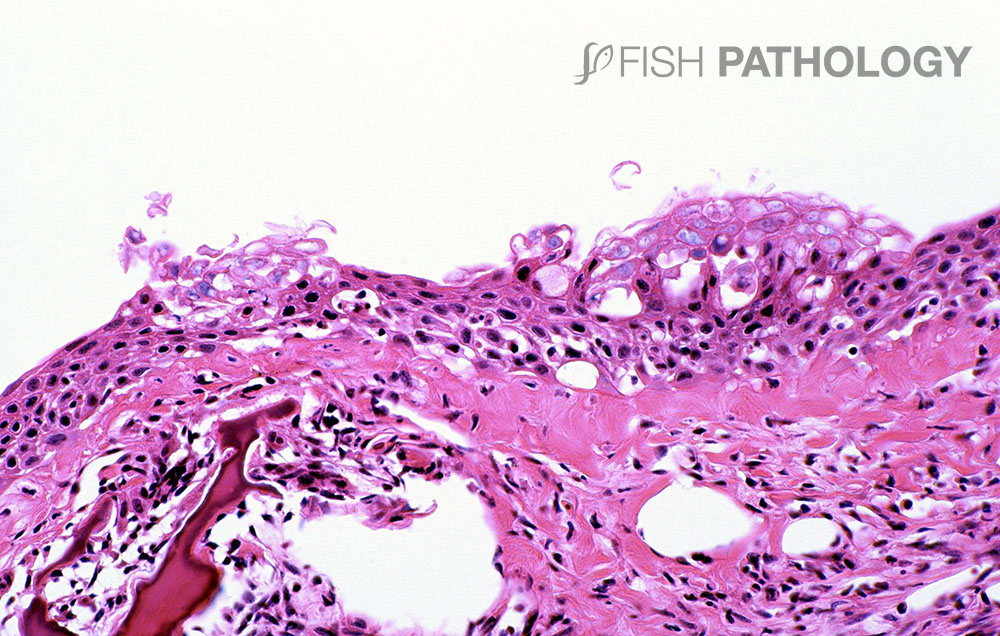
Las lesiones en piel revelan una dermatitis aguda caracterizada por un infiltrado predominantemente neutrofílico, con la presencia de agregados similares a pústulas. El estrato esponjoso dérmico usualmente está más afectado que el estrato compacto, pudiendo observarse hemorragia, necrosis tisular y edema. Generalmente el músculo esquelético subyacente no se ve afectado.
REFERENCIAS
- Baxter, E. J., Sturt, M. M., Ruane, N. M., Doyle, T. K., McAllen, R., Harman, L., & Rodger, H. D. (2011). Gill Damage to Atlantic Salmon (Salmo salar) Caused by the Common Jellyfish (Aurelia aurita) under Experimental Challenge. PLoS ONE, 6(4), e18529.doi:10.1371/journal.pone.0018529
- Baxter, E.J., Rodger, H.D., McAllen, R., Doyle, T.K., 2011. Gill disorders in marinefarmed salmon: investigating the role of hydrozoan jellyfish. Aquaculture Environment Interactions 1, 245–257.
- Ferguson, Hugh W., Delannoy, Christian, Hay, Stephen, Nicolson, James, Sutherland, David & Crumlish, Margaret. (2010). Jellyfish as Vectors of Bacterial Disease for Farmed Salmon (Salmo Salar). Journal of Veterinary Diagnostic Investigation: Inc. 22. 376-82. 10.1177/104063871002200305.
- Marcos Lopez, Mar & Mitchell, Susie & Rodger, H. (2014). Pathology and mortality associated with the mauve stinger jellyfish Pelagia noctiluca in farmed Atlantic salmon Salmo salar L. Journal of fish diseases. 39. 10.1111/jfd.12267.
- Purcell, J. E., Baxter, E. J., & Fuentes, V. L. (2013). Jellyfish as products and problems of aquaculture. Advances in Aquaculture Hatchery Technology, 404–430.doi:10.1533/9780857097460.2.404.